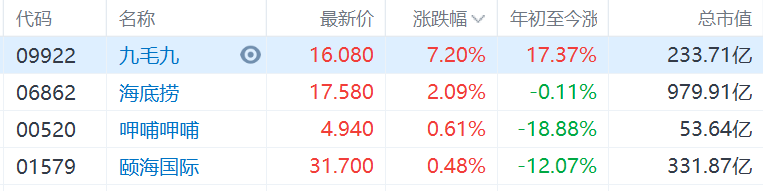
终结猜想。
在经历了两个月的市场讨论、分析师观察和猜测之后,吉利德科学终于公布了瑞德西韦的定价。
6月29日,吉利德科学董事长兼首席执行官Daniel O’Day 发布的公开信称:吉利德将供给发达国家政府的价格设定为每瓶390美元。根据目前的治疗模式,绝大多数患者将接受5天疗程的治疗,使用6瓶,相当于每位患者需支付2340美元。在美国,瑞德西韦对政府的价格同样为每瓶390美元,针对私立保险公司的价格将为每瓶520美元,5天疗程每位患者需花费3120美元。
由于新冠肺炎疫情在全球大流行,又因缺乏特效药,在各种因素合力下,吉利德的瑞德西韦被推到了世界关注的焦点,一时成为全球“最火”的药物,在疫情暴发初期更被广大网友称之为“全球的希望”。
从1月31日瑞德西韦通过《新英格兰医学杂志》(NEJM)进入大众视野,4月29日《柳叶刀》在线正式发表瑞德西韦第一项临床试验的数据结果,到6月29日,吉利德发布瑞德西韦的商业定价。
在短短不到半年的时间里,瑞德西韦在全球经历了各种临床试验,最终在多国实现获批,并快速开启了商业化之路。
在科学验证下,一直处于全球舆论风口的瑞德西韦“神话”被打破,瑞德西韦是治疗新冠肺炎的有效药但非特效药。
“横空出世”
1月31日,顶尖医学期刊《新英格兰医学杂志》在线发表了一篇关于美国首例新型冠状病毒确诊病例的论文,详细介绍了该患者就医、治疗以及临床表现。
其中最引人注意的是,2020年1月19日,一名由武汉返美的35岁男子在华盛顿州确诊为新冠肺炎,这名患者在接受了一种叫做瑞德西韦的抗病毒药物治疗后,出现了大幅改善,“截至1月30日,患者仍在住院,但除了咳嗽,其他症状都好了,而且咳嗽的严重程度在减轻”。
瑞德西韦“一战成名”。
这是疫情暴发后,瑞德西韦第一次出现在全球公众视野中。经过一轮又一轮的科普,后来大家都知道了,瑞德西韦是一种核苷酸类似物,其原理是抑制依赖RNA的RNA合成酶(RdRp),一开始是抗病毒制药公司吉利德针对埃博拉病毒所研发的。不过此前对埃博拉效果并不佳,由于新型冠状病毒里同样有RdRp,且在体外和体内动物模型中证明了对SARS和MERS等病毒病原体均有活性,研究人员推测它对于此次的新冠肺炎病毒也有效。
其时,瑞德西韦尚未在全球任何国家和地区获得许可或批准使用,吉利德首席医学官Merdad Parsey当时表示,“紧急使用瑞德西韦治疗埃博拉病毒感染患者的可用临床数据有限。尽管目前尚无瑞德西韦对新冠肺炎的抗病毒数据,但其他冠状病毒的可用数据给了我们希望。”
但这并不妨碍瑞德西韦成为各界寄予厚望的潜在有效药物。一时间,临床试验、专利纠葛、“蹭热度”抬股价的相关企业熙熙攘攘,成为疫情期间的一大“奇景”。
“我们认为瑞德西韦可能有预期效力。”在2月24日晚世界卫生组织-中国冠状病毒病联合专家考察组在北京召开的新闻发布会上,联合考察组组长Bruce Aylward博士表示。
特殊时期,各国的监管机构也都为瑞德西韦“开绿灯”。当时正是中国疫情焦灼的时期,由中日友好医院负责的两项瑞德西韦临床试验火速过审并在湖北省开展;美国食品药品监督管理局(FDA)也在迅速审评后批准了由美国国家过敏和传染病研究所(NIAID)主导的一项临床试验。此后瑞德西韦相继在全球其他疫情严重的国家展开临床试验。
瑞德西韦的临床试验或许是制药史上受关注度最高的试验,在等待揭盲的几个月中,随时随处可见全球人民翘首企盼的焦灼。
4月10日,针对瑞德西韦在全球的进展,Daniel O’Day发布了一封公开信,称目前瑞德西韦有七项临床试验已经启动,预计在4月底获得瑞德西韦针对重症患者研究的初步数据,但在中国“因入组停滞,针对重症患者的研究已停止”。成为瑞德西韦的一大转折点。
4月29日,靴子落地,同时也等来了一场“同台对垒”大戏:《柳叶刀》正式发表了瑞德西韦第一项临床试验的数据结果,即在中国湖北十家医院开展的,针对重症新冠肺炎患者的随机、双盲、安慰剂对照的多中心试验。结果显示,与安慰剂相比,接受瑞德西韦给药治疗并没有显著提高新冠肺炎患者的临床改善时间、死亡率或病毒清除时间。
换句话说,瑞德西韦的疗效不明显。
而同日,吉利德和美国国立卫生研究院(NIH)则发布公告称其临床试验显示瑞德西韦显示出积极的效果,且已达到其主要终点。接受瑞德西韦治疗的晚期患者康复速度快于接受安慰剂的患者。
尽管如此,其间还经历了FDA授予瑞德西韦“孤儿药认定”、吉利德又要求撤回等眼花缭乱的事件。5月1日,瑞德西韦迎来了监管的突破,FDA授予瑞德西韦治疗重症新冠肺炎患者的紧急使用许可(EUA),“尽管在瑞德西韦治疗新冠肺炎的使用中,关于人的安全性和有效性的信息知之甚少,但该试验药物已在一项临床试验中显示,可缩短某些患者的康复时间”。
根据NIAID等临床试验结果以及FDA的批准,瑞德西韦分别在日本、英国等国家和地区也获得了紧急使用许可。
量产和商业化能力
临床试验结果是瑞德西韦“命运”的“分水岭”。
不同的结果一出,打破了人们对其“特效药”的幻想,但瑞德西韦仍不失为临床可选的治疗药物之一。
对于业界来说,证明其有一定疗效之后,关心的焦点变成了产能和后续商业化能力。当地时间5月5日,在瑞德西韦获得FDA紧急使用授权后,吉利德发表了扩大其供应的声明。
此前Daniel O’Day也曾在公开信中表示,“我们的团队自一月起已经开始加速生产。包括在等待分配的成品和处于最后生产阶段的制剂在内,我们现有的供应量共有150万剂。我们预估这些将可用于14万个10日疗程。”
4月4日,Daniel O’Day又称,“我们目标是力争到10月份生产超过可供50万个疗程使用的药品,到今年年底的可供应量要超过100万个疗程。为了帮助我们实现并超越这一目标,我们正在建立一个由制药和化学制造商组成的联盟,他们分布在全球各地,可以扩大原材料供应和生产的全球能力。”
5月13日,吉利德宣布已经与5家位于印度和巴基斯坦的仿制药生产商签署了非独占自愿授权协议,以进一步扩大瑞德西韦的供应,并负责供应127个国家和地区。这几乎涵盖了所有低收入和中低收入国家和地区,以及一些面临显著医疗障碍的中高收入和高收入国家。
基于该授权协议,这些公司会获得吉利德关于瑞德西韦生产工艺的技术转让,以加速扩大生产规模。授权也设定了其各自生产的仿制药物的价格。
相对于捐赠和仿制药授权,华尔街和医药界更关心吉利德如何靠瑞德西韦获取回报。分析机构Evaluate Pharma称吉利德因瑞德西韦在此次疫情中的表现,股价飙升23%、市值增加180亿美元,背后也意味着巨大的商业机会。
Evaluate Pharma认为多项瑞德西韦的III期临床试验可能是目前最昂贵的投资,吉利德当然也负担得起,如果瑞德西韦真的有效,其商业回报可能是巨大的。
4月30日,吉利德公布了2020一季度业绩,营收55亿美元,同比增长5%。研发费用增长主要由于投入在瑞德西韦开发治疗新冠肺炎的费用,包括5000万美元扩大生产规模和临床试验成本。
据Daniel O’Day的说法,“我们预计在瑞德西韦的研发和生产上的投资将超过10亿美元,我们的承诺将持续到2021年及以后。”
随后引发了市场的巨大的好奇。分析机构SVB Leerink曾预测,瑞德西韦销售额可能在2022年达到77亿美元,该药物的营业利润率将在2021年达到峰值。
5月1日,非营利性研究机构临床与经济评论研究所(ICER)发布了瑞德西韦治疗新冠肺炎的不同定价模型分析,给出了两种差别巨大的估计:分别为10美元和最高上限4500美元。6月24日,ICER更新了瑞德西韦的定价模型:由于具有较高的成本效益,每位患者约4580至5080美元,但是如果低成本的类固醇地塞米松有效,瑞德西韦的价格应降至2520至2800美元之间。
从目前瑞德西韦公布的价格来看,与上述模型相符,但低于华尔街分析师的预期。
Daniel O’Day也对其定价做出了说明,每瓶390美元的价格,“其中一部分的考虑是为了消除各国就价格进行谈判的必要性。我们已将价格降低到了购买力最低的发达国家可以负担的水平。这个价格将适用于世界各地所有批准或授权使用瑞德西韦的发达国家政府。”
除了正式进入商业化运营,吉利德对于瑞德西韦的探索还未停止:将在吸入式制剂、儿科住院患者中开展实验;下一阶段临床开发将在疾病早期的治疗、与其他疗法的联合使用,以及在更多患者群体如门诊的应用中探索。(记者 卢杉)