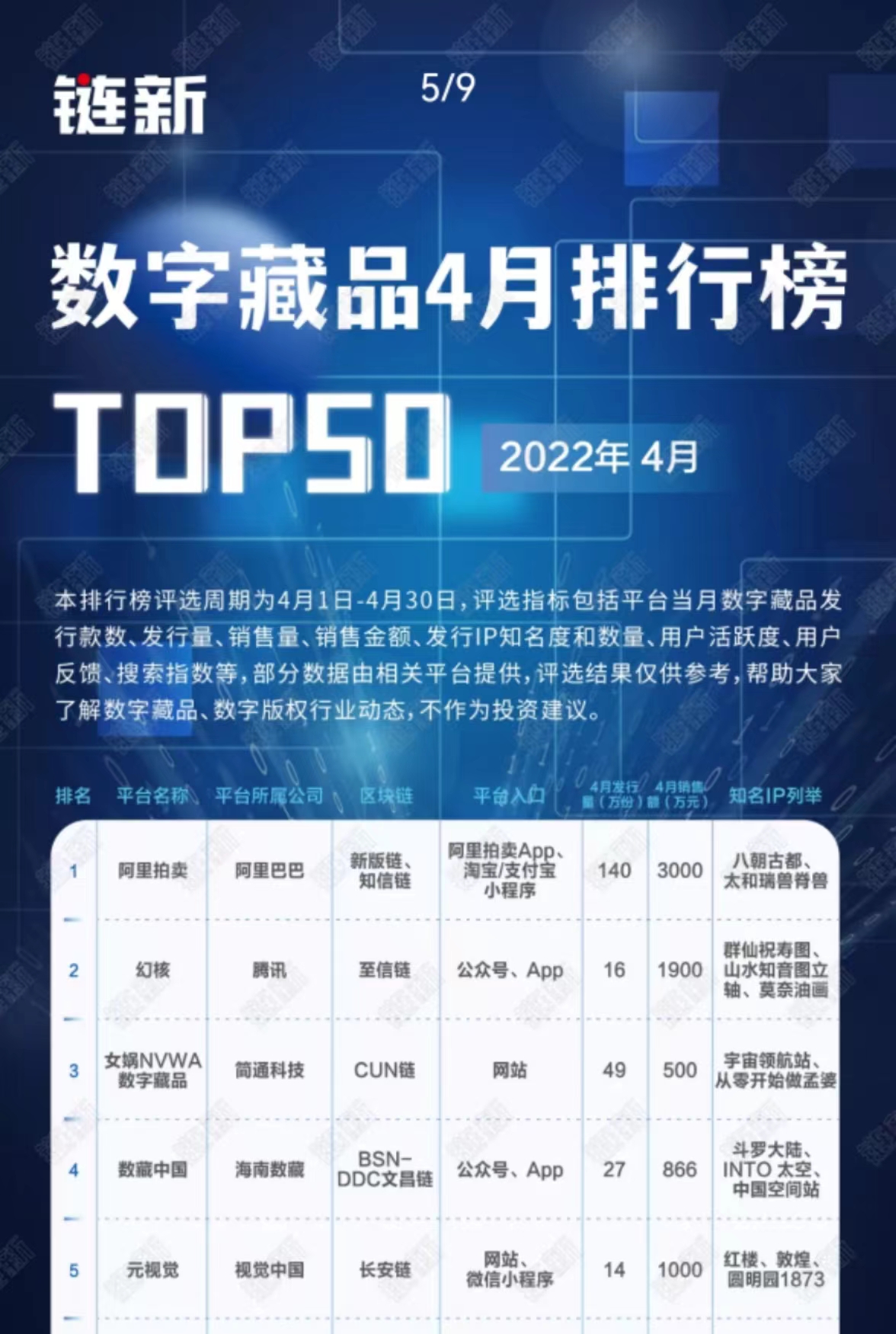
在大部分人的印象里,作为抵御病毒入侵的重要工具,疫苗是需要接种多剂次的,有首针和加强针之分。
但是来自世界卫生组织 (WHO) 的一纸建议,打破了人们的这种认知。
根据世界卫生组织免疫战略专家组 (SAGE) 的意见,只接种1剂次人乳头瘤病毒 (HPV) 疫苗,可以产生和2-3剂次同样的免疫效果,可有效预防由HPV感染引起的宫颈癌。
一石激起千层浪。4月14日,国内HPV疫苗概念股应声大跌,「HPV疫苗3针可只打1针」「HPV疫苗只打1针效果有待证实」等相关话题迅速冲上热搜。
已经接种完1针,还用接种第2针吗?众多网友在话题下陷入疑惑……
「从疫苗的作用机制和现役疫苗的接种程序来看,宫颈癌疫苗作为一种非活疫苗、一种重组蛋白疫苗,其只接种1剂的程序是非同寻常的。」 疫苗专家陶黎纳对健康界表示。
理论上而言,多数疫苗至少需要接种2剂,首剂是初次免疫,后续剂次是加强免疫,加强免疫产生的抗体,一般会比初次免疫高很多。
活疫苗由于模拟自然感染,其免疫效果会更好,存在只接种1剂的情况,例如甲肝活疫苗、喷鼻流感活疫苗、风疹疫苗等;非活疫苗普遍接种2-4剂。
「但实践第一,理论第二。」陶黎纳补充道,世界卫生组织这次推荐宫颈癌疫苗1剂程序,并且用了「坚实保护」这样一锤定音的说法,一定是掌握了大量实践证据后深思熟虑的结果,「我愿意支持之」。
「作为全球卫生政策的制定者,世界卫生组织在目前并不紧迫的情况下,发布这样一条建议,一定是基于临床研究的结果,我认为其结论是可信的。」疫苗行业资深人士林咏昭 (化名) 也对健康界表示。
然而,一众HPV疫苗企业却并不这么认为。
全球疫苗巨头默沙东称,单剂次HPV疫苗方案存在很大的不确定性,目前其对某些HPV相关癌症和疾病的长期保护力数据非常有限,同时,也没有数据显示,其对HPV引发的非宫颈癌的癌症以及对其他部分群体如男性和免疫受损人群的有效性。
此外,默沙东总部发言人指出,世卫免疫战略专家组的高级别建议草案不是最终建议,有待世界卫生组织总干事审查。当这些报告在《每周流行病学记录》中发布时,才被视为最终报告。
自2022年4月1日起,英国正式调整15岁以上人群的HPV疫苗接种计划,由原来共需接种3针,更改为接种2针,两针疫苗之间至少间隔6个月。
「国内针对HPV疫苗的评价标准比国外更加严格,实际上已经用到了防癌的标准,观察时间过长。」陶黎纳对健康界说。
他同时表示,以其对中国疫苗行业和监管「偏保守」的判断,几年内中国宫颈癌疫苗说明书上的接种程序不太可能有大的调整;对于默沙东等全球疫苗企业,2-3年内改变说明书接种程序的可能性也比较小;但对于个人来说,按世界卫生组织建议的新程序来接种宫颈癌疫苗,比说明书上的接种程序少接种1-2剂,完全可以操作。
争议之下,1剂次接种方案能够在我国落地吗?
关注健康界 感受医疗严肃与温情
1剂次替代3剂次,结论从何而来?
2009年9月,为了比较2剂和3剂四价HPV疫苗 (佳达修) 的保护效力,世界卫生组织 (WHO) 下属国际癌症研究机构 (IARC) 在印度启动了一项试验。
试验原计划募集两万名108岁未婚女性,但在募集、接种接近尾声之时,另一项HPV疫苗试验报告了7例与疫苗无关的死亡。
出于安全考虑,印度政府还是叫停了该试验。
此时,一部分受试者只打了1针,还有一部分受试者本该打3针,但只打了2针。
暂停接种后,这项临床试验自动转化为纵向队列研究,并按照实际接种情况重新分为4组:3针组 (4348人;第0天,60天,180+天接种) ,原两针组 (4980人;第0天,180+天接种) ,3针转2针组 (3452人;第0天,60+天接种) 和1针组 (4949人) 。
后在2013-2015年 (1541人) 和2017-2019年 (3631人) ,研究人员又分别募集了两批年龄、居住地与上述研究对象匹配,但没有打过HPV疫苗的已婚女性作为对照。
研究流程图
研究人员每年跟踪调查受试者的HPV疫苗再接种情况和患病情况,随访将持续至2026年8月。目前,该试验已获得10年疗效和免疫原性数据。
这些临床数据,是世界卫生组织提出修改HPV疫苗免疫程序的重要证据之一。研究者认为,第10年数据表明, 3种HPV疫苗接种计划 (单剂、两剂(0个月和6个月)、3剂) ,都提供相似的超过90%的抗HPV6/18有效率,且疫苗接种后保护效力至少延续10年。
各接种组与未接种组HPV感染情况比较
接种疫苗对HPV16/18(A)和HPV31、33、45(B)的保护作用
此外,世界卫生组织还对在肯尼亚、坦桑尼亚、哥 斯达黎加分别开展的3项试验证据进行了审查。
在肯尼亚KEN-SHE试验中,2250例15-20岁女性受试者被随机分配到三组:二价 (希瑞适) 、九价 (佳达修9) 、延迟接种 (接种脑膜炎球菌疫苗) 。结果表明,单剂希瑞适和佳达修9疫苗非常有效;两种疫苗在第18个月对HPV6/18持续感染的疫苗效力为97.5%。
同时,研究者将单剂疫苗的数据与已发表的两篇文献 (Joura et al. NEJM. 2015) 、 (Harper et al. Lancet. 2014) 数据进行了对比, 认为单剂疗效估计与多剂量方案报告的相似。
坦桑尼亚DoRIS试验 结果表明,接种希瑞适和佳达修9疫苗后24个月,单剂次免疫原性不劣于多剂次接种程序。
哥斯达黎加HPV疫苗 (CVT) 试验 结果表明,在希瑞适单剂量给药后,所有受试者体内HPV-16和HPV-18抗体水平持续数倍于自然感染,长达11年;此外,针对HPV-16/18感染的疗效,单剂二价希瑞适方案与多剂方案相似,尽管受试者数量很少。
综上,世界卫生组织认为上述试验证据表明,仅接种一针HPV疫苗,女性体内也可检测到HPV-16/18抗体,与多剂接种相比,对HPV-16/18感染的保护效率相似。
世界卫生组织因此建议修改免疫程序为:
9-14 岁女性(最优先人群)接种 1 剂次或 2 剂次;
15-20 岁女性接种 1 剂次或 2 剂次;
21 岁以上女性接种 2 剂次(间隔 6 个月)。
对于免疫功能低下的个体,包括HIV感染者,在可行的情况下,应接种3剂。如条件不允许,则至少接种2剂。世界卫生组织强调,关于该群体的单剂量疗效的证据有限。
临床终点之争,持续感染VS癌前病变?
尽管世界卫生组织关于单剂次HPV疫苗接种的建议,是建立在对试验数据的审查之上,然而,不仅相关疫苗企业表示质疑,一众券商也持怀疑态度。
国信证券医药团队在研报中指出,本次世卫免疫战略专家组审议的研究结果大多以小年龄组持续感染/免疫原性作为替代终点,标准提前,可能导致最终有效率的估计准确度下降,同时单剂接种峰值及长期抗体滴度均低于2/3剂次免疫程序,对宫颈癌长期保护效力,仍需更多数据及更长时间维度的持续跟踪。
太平洋证券也认为,通过持续感染的数据对比,可以说明单针法相对于阴性对照组的保护作用,但是通过不同接种程序的感染人数比例比较,对于疫苗的保护能力没有充分的说明。
临床试验终点提前,是业界质疑世界卫生组织结论的主要原因之一。
理论上来说,80%的性活跃女性存在HPV感染,这当中约90%可以依靠自身免疫系统在1-2年内自然消退,少部分变为持续感染,最终约1%的患者发展至子宫颈癌。
通常情况下,只有持续多年的高危型HPV感染才会引起细胞学异常改变,从HPV感染到宫颈癌产生,大概需要5-10年的时间。
目前已上市的HPV疫苗上市前临床研究,均使用高级别宫颈上皮内瘤变 (CIN) 作为主要临床终点。
但世界卫生组织近年来频繁提议,可将该标准提前:
2014年,其建议将宫颈或肛门内大于等于6个月的HPV持续感染,作为临床试验的替代终点指标,来评估疫苗有效性。
2016年,其建议将有效性评价标准更改为持续感染。
目前,欧盟和日本等国家/地区已接受HPV持续感染作为评价终点的研究结果。
2022年2月,英国疫苗接种和免疫联合委员会 (JCVI) 发布「单剂次HPV疫苗接种临时建议」报告。报告指出,现在有足够临床证据建议,将14岁以下青少年的接种计划从2剂HPV疫苗更改为单剂。
事实上,上述英国委员会自2018年起便意识到单剂次HPV疫苗的潜力,而对单剂接种计划的审查是在2020年6月进行的。「尽管 (当时) 相关证据表明,单剂次HPV接种计划是发展方向,但我们希望在就HPV疫苗接种计划提供建议前,看到更多证据,尤其是关于九价疫苗的证据。」报告中如此写道。
如今,在对前述肯尼亚KEN-SHE试验、坦桑尼亚DoRIS试验、印度国际癌症研究机构试验、哥斯达黎加CVT试验,以及多项九价疫苗的有效性研究的临床证据进行审查之后,上述英国委员会认为转向单剂次的证据是令人信服的,并且与支持从3剂改为2剂的证据水平相似,甚至更高。
「HPV疫苗接种后,抗体的大部分衰退发生在疫苗接种后的前6-8个月,然后是稳定期,目前已观察到抗体保持稳定超过10年。单剂HPV疫苗的有效性,与观察到的2剂或3剂疫苗的有效性一样高。」 上述英国委员会称。
截至目前,英国卫生安全局 (UKHSA) 尚未通过该临时建议,不过自2022年4月1日起,英国正式调整15岁以上人群的HPV疫苗接种计划,由原来共需接种3针,更改为接种2针,两针疫苗之间至少间隔6个月。
「从宫颈癌发展进程来说,持续感染是第一步,癌变是第二步,如果临床试验表明单剂次疫苗对持续感染的保护效力已经比较高了,那我认为世界卫生组织的结论没有问题。」林咏昭对健康界表示。
陶黎纳也认为,HPV疫苗只要能够预防持续感染便已足够。
「国内针对HPV疫苗的评价标准比国外更加严格,实际上已经用到了防癌的标准,观察时间过长。」
2020年5月,世界卫生组织总干事癌症防治专家组成员乔友林作为通信作者在《中国科学基金》上发表论文指出,大量数据证明了以HPV持续感染 (间隔至少6个月连续两次检测同一HPV亚型阳性) 作为HPV疫苗有效性评估终点的科学性和合理性。在保障高质量临床研究和评价的条件下,为加速我国HPV预防性疫苗的研发,相关部门应在目前的科学证据基础上,积极地考虑以HPV 持续感染作为临床评价替代终点观察指标的可行性。
世界卫生组织建议难落地?
临床试验终点争议之外,业界认为世界卫生组织建议在中国难落地的另一原因在于,世界卫生组织提出用1/2针代替目前2/3针接种程序,主要是为了提升中低收入国家的HPV疫苗覆盖率,但单针法被中国国家药监局接纳的可能性较低。
「从历史角度来看,世界卫生组织在葛兰素史克和默沙东上市两款HPV疫苗后,曾建议以持续感染数据来替代CIN2作为临床终点。建议的目的在于,可以减少HPV疫苗临床试验的时间。但是我国药监出于对于安全性和保护力考虑,坚持以CIN2为临床终点,从而可以切实保证疫苗的保护效果。从这个角度而言,单针法被接纳的可能性低。」太平洋证券在研报中表示。
但事实上,一方面,如前文所述,关于用持续感染来替代CIN2作为临床终点的证据近年来已愈见充分;另一方面,我国也面临着与世界卫生组织同样的难题——提升HPV疫苗的渗透率。
2020年11月,世界卫生组织 发布《加速消除宫颈癌的全球战略》,包括中国在内的194个国家承诺在2030年前为90%以上的94岁女孩接种HPV疫苗。
2017年,二价HPV疫苗在我国首次获批签发,之后四价、九价疫苗也陆续进入中国市场。根据信达证券研报,2017-2021年,我国HPV疫苗批签发总量分别约为146、 713、1087、1544、3249万支;根据OECD数据库,2021年我国9-45岁女性人口约为3.22亿人,按照3针接种程序粗略测算,2021年我国HPV疫苗累计渗透率为 6.99%。
距离承诺的2030年接种目标,我国尚有很大一段差距。而HPV疫苗在我国渗透率之所以提升缓慢,其背后一大主要原因是疫苗产能不足。
据沙利文数据预计,到2025年,国内仍将有2.34亿名9至45岁的女性未接种HPV疫苗,在假设每人3剂的情况下,除现有产能外,则可能还需要额外的7.02亿剂。
「单剂量接种,可更快帮助实现2020年提出的消除宫颈癌倡议。」世卫组织助理总干事)Simelela表示,单剂次接种的成本更低、占用资源更少,且更容易管理,节省下来的卫生经费和人力资源可以用于其他卫生事项。
一项针对北京地区人群HPV疫苗接种意愿的研究 (李娟等,2021) 显示,阻碍 HPV 疫苗接种的前3位供方因素为:
工作人员不足
工作负荷增大
疫苗供应不足
而HPV 疫苗适龄接种人群中,未接种疫苗的主要原因分别为:
没有时间接种
疫苗价格高
担心疫苗安全性和效果
此外,在另外一项范围扩大到全国的调查 (张希等,2021) 中,36.86%的受访女性愿意支付≧1000元/3剂购买HPV疫苗,45.15%的女性只愿意支付≦100元/3剂,价格因素严重阻碍了HPV疫苗的接种。
目前,全球已上市的HPV疫苗分为3类:二价、四价、九价,涉及4家生产企业5款产品,分别是葛兰素史克的二价HPV疫苗、默沙东的四价HPV疫苗、默沙东的九价HPV疫苗、万泰生物(603392)的二价HPV疫苗、沃森生物(300142)的二价HPV疫苗。
其中,后两款为国产疫苗,仅在国内销售;默沙东的HPV疫苗在国内由智飞生物(300122)独家代理销售。
从定价来看,最便宜的国产二价HPV疫苗,单剂价格为300元左右,免疫程序为3剂,94岁女性也可采用2剂程序。但即使是这个价格,亦超出了前述调查中多数女性愿意支付的范围。
为提升HPV疫苗在我国的渗透率,国家卫健委自2021年起逐步在15个试点地区推行适龄人群二价HPV疫苗免费或补助接种,同时鼓励有条件的地区积极采用多种筹资模式,逐步开展HPV疫苗免费接种。
「如果世卫组织更新宫颈癌疫苗立场文件,不排除后续出台免费接种政策的地区,会采用这种说明书以外、但成本减半的单剂策略,因为免费疫苗政府买单,对成本非常敏感。」 陶黎纳说。
不过,陶黎纳同时表示,以其对中国疫苗行业和监管「偏保守」的判断,几年内中国宫颈癌疫苗说明书上的接种程序不太可能有大的调整;对于默沙东等全球疫苗企业,2-3年内改变说明书接种程序的可能性也比较小;但对于个人来说,按世界卫生组织建议的新程序来接种宫颈癌疫苗,比说明书上的接种程序少接种1-2剂,完全可以操作。
「疫苗接种程序是基于之前的临床试验结果确定的,如果要改变,需要由企业向国家药品监督管理局提交新的临床试验方案,并在批准后方可进行临床试验,如果得到预期结果,才能改变原有的接种程序。」林咏昭表示,从过往经验来看,短期内,国家层面或企业层面主动去推动疫苗免疫程序调整的可能性较小。
比尔及梅琳达·盖茨基金会高级项目官杜珩对健康界表示:「我们呼吁国内HPV疫苗研发生产企业和临床研究者加强单剂次程序的临床开发和真实世界研究,以使国产HPV疫苗更符合世卫组织推荐的免疫程序。」